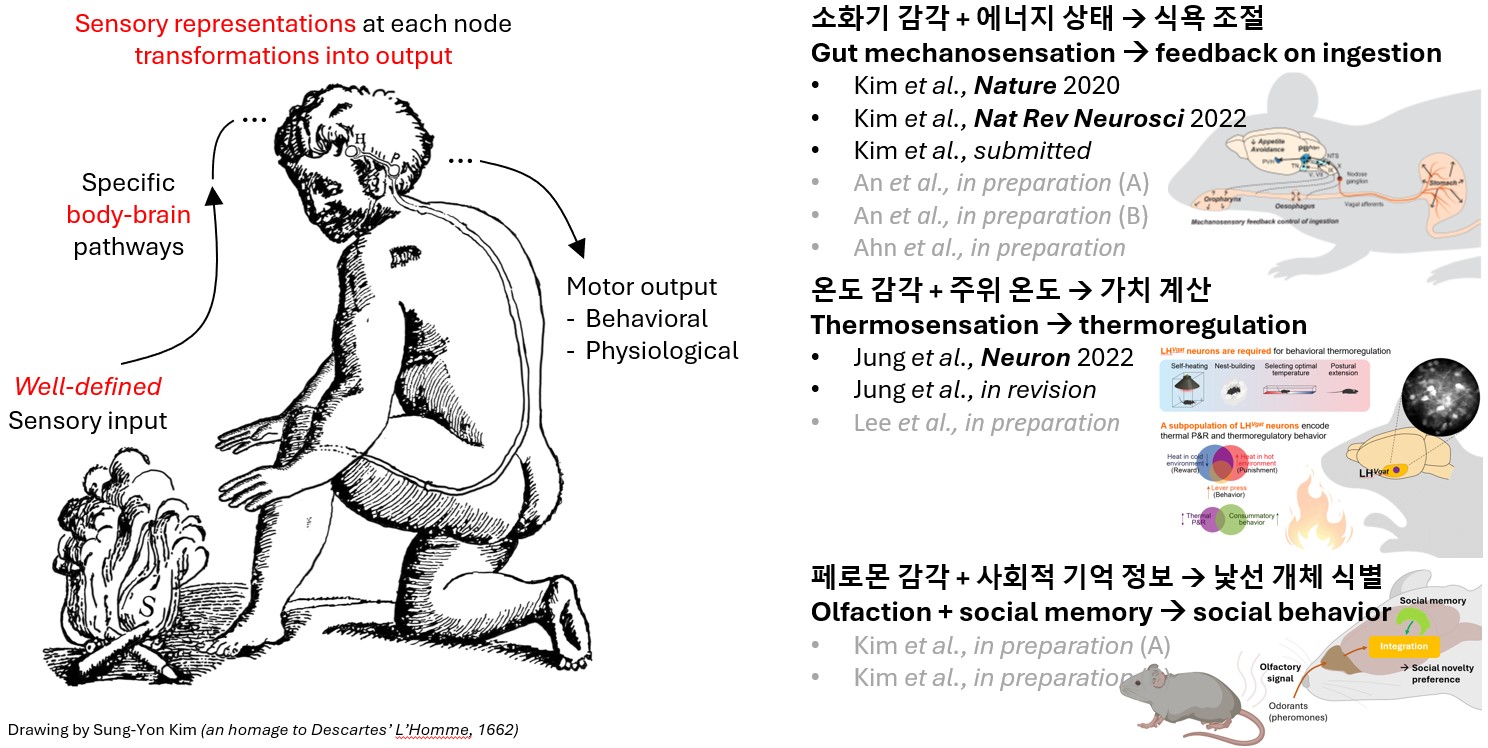
How is sensory input transformed into appropriate behavioral and physiological output?
뇌 신경계를 입-출력 신호변환(input-output transformation)을 일으키는 정보 통합 및 처리 장치(integrative center)로 보는 접근은 17세기 철학자 데카르트로부터 시작된 오랜 전통에 뿌리를 두고 있습니다. 저희 연구실은 복잡한 뇌에 대한 기계론적 이해(mechanistic understanding)를 목표로 하며, 환원주의적 철학을 바탕으로 신경회로와 정보 처리 메커니즘을 분자, 세포, 회로, 행동 수준에 걸쳐 정확히 밝혀내고자 합니다.
이를 위해 저희는 명확하게 정의된 감각 입력(well-defined sensory input)을 이용하여 몸-뇌 의사소통(body-brain communication)의 신경회로를 정밀하게 매핑합니다. 또한, 각 신경 회로의 구성 요소들이 감각 자극을 어떻게 인코딩(encoding)하고, 이 과정에서 발생하는 필터링, 신호증폭, 시간적/공간적 합산, 정보 통합과 같은 신호 처리 과정을 면밀히 분석합니다. 이를 통해 궁극적으로 행동과 생리적 반응이 어떻게 발생하는지에 대한 정확한 메커니즘을 밝혀내는 것을 목표로 하고 있습니다.
저희 연구는 섭식(ingestion), 체온 조절(thermoregulation), 사회적 행동(social behavior)이라는 세 가지 상호 연관된 본능적 행동에 집중하고 있습니다. 이 행동들은 모든 동물의 생존에 필수적인 근본적 생리적 반응으로, 진화적으로 잘 보존되어 있습니다. 또한 이들 행동은 압력, 온도, 페로몬 자극과 같이 정량적으고 정확하게 실험쥐에 전달할 수 있는 자극에 의해 조절되므로, 이러한 자극이 처음 감지되는 순간부터 신호가 신경계를 통해 전달되는 경로를 찾아내고 그 특성을 체계적이고 정확하게 밝혀낼 수 있습니다. 감각 정보의 전달 경로에 대한 확실한 지식을 바탕으로, 저희는 감각 신호가 통합되고, 이에 따른 행동적 및 생리적 반응을 일으키는 신경회로 신경회로 메커니즘을 규명하고 있습니다.
나아가, 이러한 연구 결과를 바탕으로 몸-뇌축 신경회로 조절 기술을 개발하며, 비만, 스트레스, 우울증, 분노조절장애 등 병적 상태에 대한 혁신적인 치료 방법을 제시하고자 합니다.
저희 연구실은 현대 신경생물학의 최신 기술을 적극 활용하며, 필요한 경우 새로운 기술을 직접 개발합니다. 대부분의 기술이 실험실 내에 자체적으로(in-house) 갖추어져 있어 효율적인 연구 진행이 가능합니다. 대표적으로, 뇌심부 단일세포 이미징과 자극이 가능한 two-photon 현미경과 공초점 현미경을 구비하고 있으며, 광유전학(optogenetics), 화학유전학(chemogenetics), 전기생리학(slice patch-clamp), 조직학, 다채널 RNA FISH, 각종 행동 및 생리학 실험 장비 등 필요한 모든 기술이 갖추어져 있습니다. 또한, 저희는 CLARITY, ZOOM과 같은 3차원 조직 투명화 및 이미징 기술의 개발에 참여했으며, 화학공학, 재료공학, 광학, 전자공학 등 다양한 분야의 전문가들과 활발히 공동연구를 진행하고 있습니다.
저희 연구실의 전체 논문 목록을 PubMed나 Google Scholar에서 보실 수 있습니다.
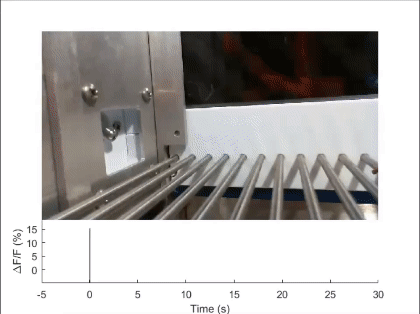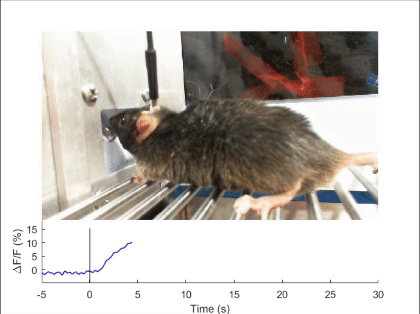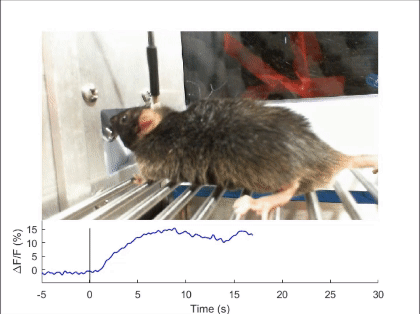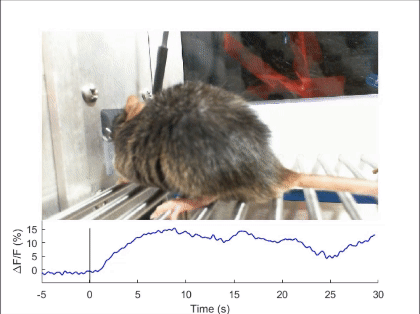
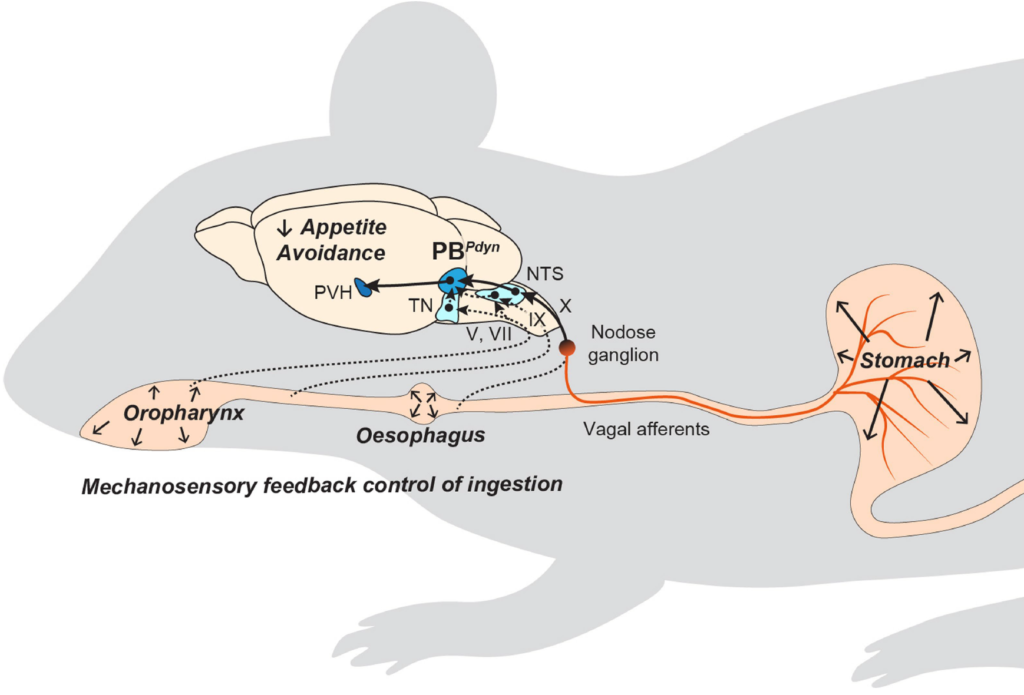
장-뇌축 신경회로에 의한 섭식 행동의 조절
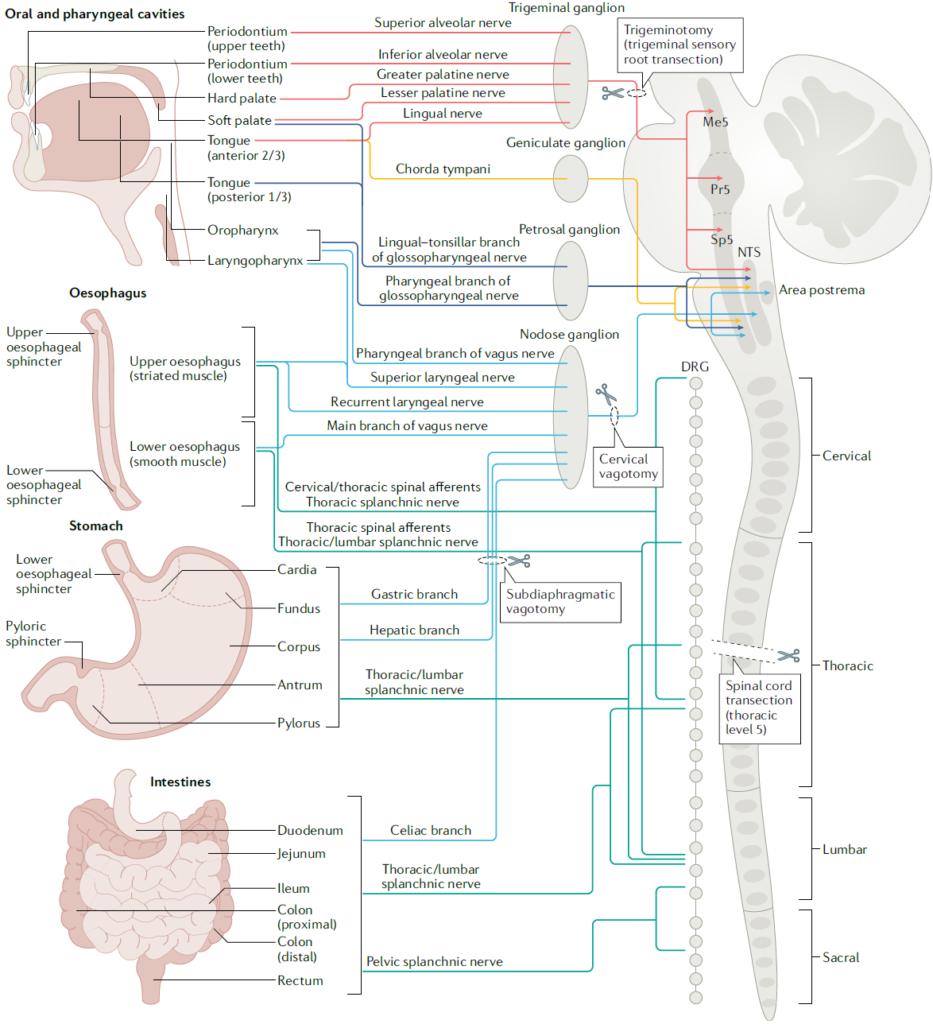
음식물을 먹거나 마시면, 음식은 입, 식도, 위, 장을 따라 이동하며 소화관 벽에 기계적 자극(mechanical stimulus)을 주게 됩니다. 이로 인해 발생하는 기계적 감각(mechanosenation)의 피드백 신호는 뇌로 전달되어 음식물의 섭취 속도와 양을 모니터링하고, 과도한 섭취를 억제하는 역할을 합니다(Nat Rev Neurosci 2022). 그러나 이 신호가 소화관의 어디에서 발생하며 어떤 경로로 뇌로 전달되어 식욕 억제 신호를 발생시키는지는 여전히 불분명합니다. 2020년에 발표한 논문에서, 저희는 소화관 팽창과 같은 물리적 자극을 감지하는 뉴런을 뇌에서 처음으로 발견하고 보고하였습니다(Nature 2020). 특히, 후뇌 부완핵(parabrachial nucleus)에서 Pdyn 유전자를 발현하는 뉴런들이 상부 소화관의 물리적 감각 신호를 받아 음식 섭취를 조절한다는 사실을 밝혔습니다. 이 신호가 전달되면, 해당 뉴런들이 활성화되어 지속적이고 부정적인 감정을 동반하는 음성 피드백 신호를 발생시키며, 이로써 과식과 과음을 방지합니다. 저희는 계속해서 이러한 물리적 감각 신호가 발생하는 위치, 신경 신호로 변환되는 메커니즘, 그리고 장-뇌축 신호전달 경로를 심도있게 연구하고 있습니다.
물을 마시면 어떻게 갈증이 빠르게 해소될까?
목이 마를 때 물을 마시면 수 초 안에 갈증이 해소됩니다. 그러나 이때 물은 아직 장에 도달하지 않았고, 체내 항상성이 회복되기까지는 수십 분이 걸립니다. Claude Bernard (1813-1878)와 Water Cannon (1871-1945) 같은 현대 생리학의 선구자들도 이 빠른 갈증 해소 신호의 원천을 찾고자 했지만, 이 기본적인 현상은 여전히 미지로 남아 있습니다. 저희 연구진은 이 신호의 원천을 찾고, 이를 뇌 안의 갈증 센터까지 연결하는 회로를 모두 규명하였습니다. 더 나아가, 이 과정에서 일어나는 high-pass filtering 메커니즘이 중요한 역할을 한다는 것을 발견했습니다. 이 신호는 갈증 해소뿐 아니라, 음수 시 물 보상(water reward) 신호의 원천으로 기능하는 것으로 보입니다. 곧 발표될 논문에서 그 내용을 확인하세요!
배가 부르면 어떻게 포만감이 생겨날까?
과식 후 위장이 팽창하면, 더 이상 음식을 섭취하기 어렵습니다. 위의 부피가 뇌에서 모니터링되고 있을 것으로 추정되지만, 놀랍게도 이를 추적하는 특정 뇌 뉴런 집단은 아직 명확히 밝혀지지 않았습니다. 저희 연구진은 이 뉴런 집단을 찾고, 식욕 억제 신호로의 변환 과정을 연구 중입니다. 또한, 이 메커니즘이 최근 주목받는 Wegovy와 같은 비만 치료제의 식욕 억제 효과에 기여할 가능성을 연구하고 있습니다. 나아가, 이러한 메커니즘을 활용하면 요요현상 없는 비만 치료가 가능할 것으로 보고 그 가능성을 탐구 중입니다.
스트레스를 받으면 왜 식욕이 떨어질까?
스트레스는 현대인들에게 다양한 질병의 원인이 되며, 특히 섭식 장애의 중요한 요인입니다(관련 리뷰: EMM 2022, EN 2022). 그럼에도 불구하고, 스트레스가 식욕 감소로 이어지는 구체적인 메커니즘에 대해 우리가 아는 바는 매우 적습니다. 저희는 최근 이 연결고리를 찾아내어 스트레스성 식욕 저하의 메커니즘을 규명하고 있으며, 관련 연구를 활발히 진행 중입니다. 내년쯤 나올 논문에서 그 결과를 확인하세요!
미주신경을 자극해 비만과 당뇨를 치료할 수 있을까?
미주신경은 위, 장, 신장, 심장, 폐 등 거의 모든 장기와 뇌를 연결하는 양방향 소통 경로로, 최근에는 미주신경 자극을 통해 다양한 신경, 정신, 대사 질환을 치료하려는 시도가 주목받고 있습니다. 하지만 미주신경은 다양한 가지로 나뉘어 있어, 현재의 기술로는 특정 가지를 선택적으로 자극하는 것이 어렵고 부작용이 발생할 수 있습니다. 저희는 특정 미주신경 가지만을 정확히 자극하는 방법을 개발하고 있으며, 비침습적 원격 자극 기술에서 이미 성공적인 성과를 거두고 있어, 향후 발전이 더욱 기대됩니다. 이를 통해 부작용 없이 식욕을 조절하거나 소화기 질환을 치료하고, 나아가 스트레스, 우울증 등을 개선하는 기술 개발이 가능할 것으로 전망합니다.
- Kim et al. A neural circuit mechanism for mechanosensory feedback control of ingestion. Nature 2020
_*featured as Highlight, Nature Reviews Gastroenterology & Hepatology 2020
_*2021년 국가연구개발 우수성과 100선 선정
_(연구실 소식 소개글, 언론보도 및 관련 강연 영상, 관련 기고문 1, 기고문 2) - Kim et al. Neural signalling of gut mechanosensation in ingestive and digestive processes. Nature Reviews Neuroscience 2022
_(연구실 소식 소개글) - Ahn et al. Brain circuits for homeostatic and non-homeostatic appetites. Exp Mol Med. 2022
- An et al. Lateral septum somatostatin neurons are activated by diverse stressors. Exp Neurobiol. 2022

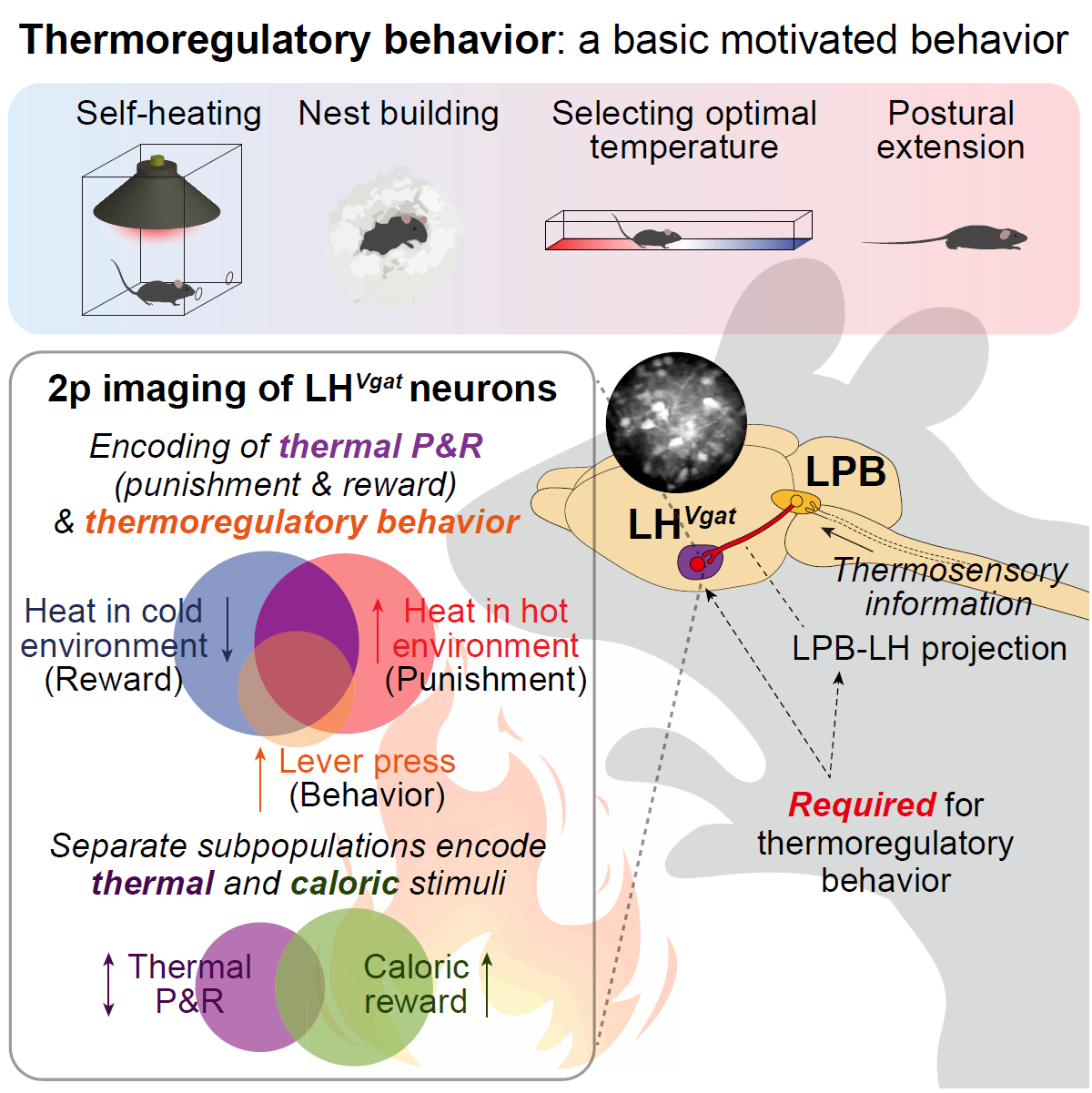
추울 때 어떻게 더위를 찾게 될까?
체온 조절 행동은 체온 항상성 유지를 위한 가장 근본적인 동기 부여 행동입니다. 이러한 중요한 생리적 과정임에도 불구하고, 이 행동을 조절하는 구체적인 메커니즘은 놀라울 정도로 연구가 부족한 상태였습니다. 특히, 최근까지도, 체온 조절 행동에 필수적인 특정 뉴런 집단이나, 관련된 뇌의 주요 부위조차 밝혀지지 않았습니다. 저희 연구진은 2022년 Neuron에 발표한 논문에서 외측 시상하부(lateral hypothalamus)의 Vgat유전자를 발현하는 뉴런들이 다양한 체온 조절 행동을 담당하는 핵심 뉴런임을 최초로 발견하였습니다(Neuron 2022). 이 뉴런들이 체온 항상성에 위협을 가하는 온도 자극을 피하려는 동기 유발 신호를 인코딩한다는 사실을 밝혀냈습니다. 이 인코딩 패턴은 부완핵에서 전달되는 온도 감각 신호를 통해 일어나는 것으로 보입니다.
현재 저희는 이광자 현미경 이미징, Cal-Light 기술 등을 활용해 외측 시상하부 Vgat뉴런들이 기능적으로 세분화된 여러 하위 뉴런 집단으로 구성되어 있음을 밝히고 있으며, 이들의 정확한 기능을 밝히는 데 집중하고 있습니다.
또한, 저희는 피부에서 발생하는 온도 감각이 어떻게 뇌로 전달되는지 그 경로를 정의하고, 이 경로가 보상(reward) 또는 처벌(punishment)이라는 가치(value)로 평가되는지, 즉 동기 부여와 가치 계산이 뇌에서 어떻게 생겨나는지를 연구하고 있습니다. 한편, 저희 연구실은 염증이나 스트레스에 의해 발생하는 발열(fever) 상황에서 체온 조절 행동 및 관련 신경 신호(가치와 동기 부여 신호)의 인코딩이 어떻게 변화하는지도 심도 있게 연구하고 있습니다.
- Jung et al. A forebrain neural substrate for behavioral thermoregulation. Neuron 2022
_*featured as Previews, Neuron 2022.
_(연구실 소식 소개글, 언론보도 및 관련 강연 영상)
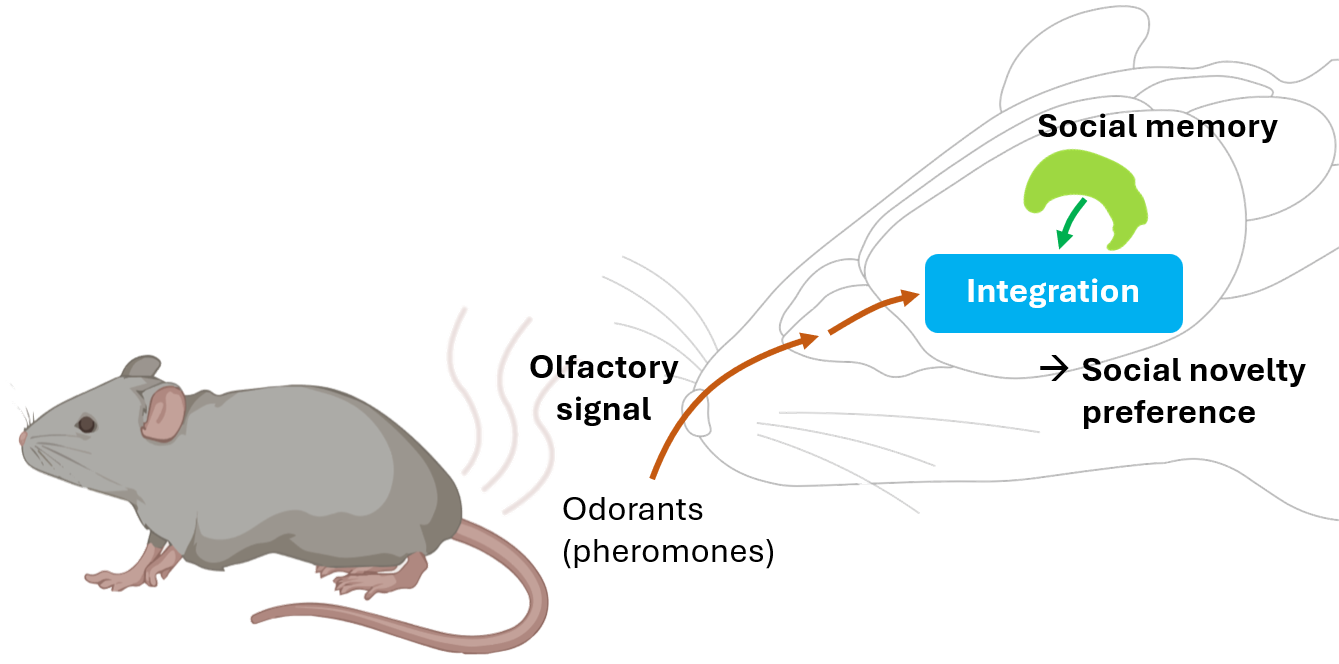
우리는 어떻게 낯설거나 친숙한 개체를 구별할까?
우리를 포함한 사회적 동물들은 낯선 개체와의 사회적 상호작용을 우선시하는 사회적 새로움 선호(social novelty preference)현상을 보입니다. 이는 무리지어 사는 동물들의 생존에 필수적인 행동으로, 사회적 관계를 형성하고 유지하는 데 중요한 역할을 합니다. 하지만 이러한 행동의 구체적인 메커니즘에 대한 연구는 매우 부족합니다. 실험쥐에서 사회적 후각 신호는 이 현상에서 중요한 역할을 할 것으로 여겨지며, 후각 정보와 뇌에 저장된 사회적 기억이 통합되어 낯선 개체와 친숙한 개체를 구별해내는 것이 이 현상의 핵심 과정입니다. 하지만, 이 감각 정보가 어떻게 통합되고 처리되는지는 그동안 거의 연구되지 않았습니다.
저희 연구진은 페로몬 신호를 감지하는 마우스의 특정 후각 기관이 사회적 새로움 선호의 감각적 근원임을 발견하였고, 이 신호가 뇌로 전달되는 경로와 뇌에 저장된 사회적 기억과 통합되는 중추 신경 회로까지 규명하였습니다. 현재 저희는 사회적 감각 정보와 기억 정보가 어떻게 통합되는지, 그리고 이 과정이 어떻게 낯선 개체에게 다가가는 동기 부여 행동을 일으키는지 연구를 진행하고 있습니다(관련 리뷰: Mol Cells 2021).
- Kim and Kim. Functional dissection of glutamatergic and GABAergic neurons in the bed nucleus of the stria terminalis. Mol Cells. 2021
과거 연구(김성연 교수의 박사과정, 박사후 과정 연구 및 연구실 초기의 연구)

불안 상태를 조절하는 확장된 편도체 회로
김성연 교수의 박사과정 연구는 편도체(amygdala)와 확장된 편도체(extended amygdala)의 특정 뉴런 집단과 투사(projection)들이 전체적인 불안 수준이나, 불안 상태의 특정 요소를 어떻게 조절하는지 규명한 것으로, 이 연구 결과는 두 편의 논문으로 출판되었고(Nature 2011, Nature 2013), 미 신경과학회(SfN)에서 수여하는 Donald B. Lindsley Prize를 수상함으로서 그 성과를 국제적으로 인정받았습니다. 이 기간 동안 김 교수는 불안, 우울장애 등의 신경회로 메커니즘을 밝히는 연구에 다수 참여하였고(Nature 2012, Nature 2013, Nature 2015), 관련 리뷰 논문을 작성하기도 하였습니다(Brain Res 2013).
- Tye*, Prakash*, Kim* et al. Amygdala circuitry mediating reversible and bidirectional control of anxiety. Nature 2011
- Kim et al. Diverging neural pathways assemble a behavioural state from separable features in anxiety. Nature 2013
_*featured as News and Views, Nature 2013 - Warden et al. A prefrontal cortex-brainstem neuronal projection that controls response to behavioural challenge. Nature 2012
- Tye et al. Dopamine neurons modulate neural encoding and expression of depression-related behaviour. Nature 2013
- Adhikari et al. Basomedial amygdala mediates top-down control of anxiety and fear. Nature 2015
- Nieh et al. Optogenetic dissection of neural circuits underlying emotional valence and motivated behaviors. Brain Res. 2013

3차원 조직 투명화, 팽창, 염색 및 이미징 기술 개발
김성연 교수는 광유전학(optogenetics)과 조직 투명화 기술(CLARITY)을 개발한 연구진에서 박사과정 및 박사후 연구를 수행하며 최신 기술을 빠르게 받아들여 과학적 질문을 누구보다 앞서서 해결하는 것의 중요성을 잘 알고 있고, 또한 확률적 전기수송(stochastic electrotransport) 기법의 개발을 이끌고 CLARITY, SWITCH등의 개발에 기여하는 등 신경과학 외에도 의생명과학 전반에 큰 파급효과를 가진 3D 조직 투명화 기반 이미징 기술의 개발에 앞장선 바 있습니다(Nature 2013, Trends Cogn Sci 2013, PNAS 2015, Cell 2015). 저희 연구실은 생체재료화학, 나노과학, 미세유체칩, 오가노이드 등 각 분야를 이끄는 국내의 타 분야 연구진과의 활발한 공동연구를 통해 ZOOM, OMNIA 등 다양한 기술을 개발해 왔습니다(Adv Sci 2019, ACS Appl Mater Interfaces 2021, Bioconj Chem 2020, ACS Nano 2021, Acta Biomater 2022, Sci Adv 2022; 관련 리뷰 Mol Cells 2016; 관련 북 챕터 Seo et al. 2019).
- Chung et al. Structural and molecular interrogation of intact biological systems. Nature 2013
- Kim et al. Light microscopy mapping of connections in the intact brain. Trends Cogn Sci. 2013
- Kim et al. Stochastic electrotransport selectively enhances the transport of highly electromobile molecules. Proc Natl Acad Sci U S A. 2015
- Murray et al. Simple, Scalable Proteomic Imaging for High-Dimensional Profiling of Intact Systems. Cell 2015
(이하: 신경회로 연구실에서의 연구성과)

- Park et al. Scalable and isotropic expansion of tissues with simply tunable expansion ratio. Adv Sci. 2019
_*featured as the Front Cover - Kang et al. Reversible expansion microscopy using thermally adjustable expansion factor using thermoresponsive biospecimen-hydrogel hybrids. ACS Appl. Mater. Interfaces. 2021
- Koo et al. Large-scale 3D optical mapping and quantitative analysis of nanoparticle distribution in tumor vascular microenvironment. Bioconjugate Chem. 2020
_*featured as the Front Cover - Lee S, et al. 3D microfluidic platform and tumor vascular mapping for evaluating anti-angiogenic RNAi-based nanomedicine. ACS Nano. 2021
- Ahn et al. 3D microengineered vascularized tumor spheroids for drug delivery and efficacy testing. Acta Biomater. 2022
- Pac et al. Three-dimensional imaging and analysis of pathological tissue samples with de novo generation of citrate-based fluorophores. Sci Adv. 2022
- Seo et al. Clearing and Labeling Techniques for Large-Scale Biological Tissues. Mol Cells. 2016
- Seo et al. Chemical Processing of Brain Tissues for Large-Volume, High-Resolution Optical Imaging. In: Kao, Keiser, Gogoi. (eds) Advanced Optical Methods for Brain Imaging. Springer (Book chapter). 2019